上海吉玛制药技术有限公司
18 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
公司新闻/正文
AAV 研究指南-肝脏篇
794 人阅读发布时间:2025-06-27 15:54
一.肝脏和AAV简介
肝脏是人体最重要的器官之一,参与许多物质代谢和排毒进程。肝脏血管系统与其他器官相比是独.一无.二的,因为它是由三个主要网络,包含两个入口和一个出口叠加而成的(图1)。两个入口网络,即肝动脉(HA)和门静脉(PV),彼此平行运行。肝动脉为肝脏提供含氧血,门静脉为肝脏提供脱氧血。窦状体均匀分布于整个肝脏体积,构成肝脏微循环。肝小叶是实现肝脏功能的基本结构单位,为柱状多面体,主要由肝细胞组成的肝板(Hepatic plate)、中央静脉(Central vein)、肝血窦(Sinusoid)以及毛细胆管(Bile canaliculus)等微小结构组成。[1]
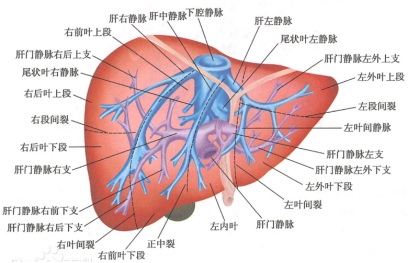
图1. 肝脏结构示意图(来源于网络)
肝脏主要由若干种不同胚胎起源的细胞类型组成,包括肝细胞、胆道上皮细胞(胆管细胞)、星状细胞、Kupffer细胞和肝窦内皮细胞等。肝细胞是最常见的肝脏细胞种类,约占肝脏细胞总数70%,具有多种功能,包括合成、分解和分泌多种物质。胆管细胞是肝脏中第二丰富的上皮细胞群,作为胆管腔内的细胞,具有传统的上皮功能和胆汁的分泌功能。肝星状细胞位于肝窦间隙内,负责维持低密度基质和维生素A的储存。Kupffer细胞是肝脏的常驻巨噬细胞群,这些细胞能够识别多种致病刺激并发挥促炎或抗炎作用,目前被广泛认为与肝脏纤维化形成有关。肝窦内皮细胞是一种特殊的内皮细胞群,这些细胞在窦腔形成有孔的筛板,对于血浆和肝脏细胞类型之间物质交换起到筛选作用,同时保持一定的屏障功能。[2]
rAAV(重组腺相关病毒)是一种非致病性病毒载体,可以感染分裂或非分裂细胞,是目前用于向肝细胞基因递送的主要载体之一。选择合适的血清型、特异性启动子和注射方式可以有效提高外源基因在肝组织特异性表达效率。
二.血清型和启动子推荐
在肝脏研究中,血清型AAV8和AAV9在肝脏上都有较强的倾向性,但AAV8更适合肝脏。在动物实验中,相对于操作难度较大的肝门静脉注射,AAV8通过尾静脉注射也能达到近似的效果。(详见下列数据)
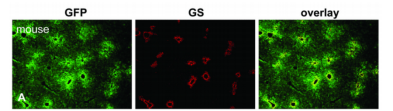
|
病毒类型 |
rAAV8-TBG-GFP |
|
感染动物 |
成年小鼠 |
|
感染脏器 |
肝脏 |
|
注射方案 |
尾静脉注射 1.0*10^11 VG/只 |
|
检测方法 |
注射7天后,取肝进行免疫荧光检测 |
|
图片来源 |
10.1016/j.ymgme.2011.06.002. |
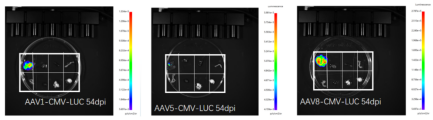
【注】:肝源表达强度AAV8>AAV1>AAV5
|
病毒类型 |
rAAV8-CMV-Luc |
|
感染动物 |
C57BL/6 小鼠 6周龄 |
|
感染脏器 |
肝脏 |
|
注射方案 |
尾静脉注射1*10^11 VG/只 |
|
检测方法 |
注射后8周活体成像 |
|
图片来源 |
吉玛基因 |
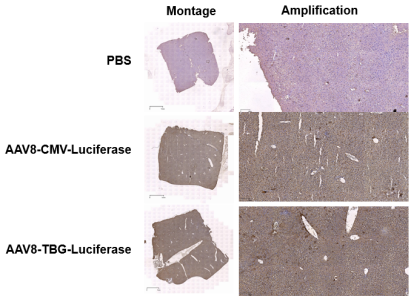
|
病毒类型 |
rAAV8-CMV-Luc/rAAV8-TBG-Luc |
|
感染动物 |
C57BL/6 小鼠6周龄 |
|
感染脏器 |
肝脏 |
|
注射方案 |
尾静脉注射2*10^11 VG/只 |
|
检测方法 |
注射后12周取肝脏做免疫组化(一抗:anti-luciferase) |
|
图片来源 |
吉玛基因 |
三.注射方法选择
肝脏研究中AAV的主要的注射方法有以下几种(见表1)。其中,非手术的注射方法有腹腔注射和尾静脉注射;需要手术的有肝门静脉注射、肝实质注射和脾包膜内注射。
表1. AAV感染肝脏注射方式对比
|
方法 |
优点 |
缺点 |
注射剂量参考 |
AAV滴度 |
|
尾静脉注射 |
侵入性小,操作容易 |
靶向性相对较差,需要借助特异性启动子 |
100-200uL |
1*10^12 VG/mL |
|
腹腔注射 |
200-300uL |
|||
|
肝门静脉注射 |
靶向递送,效率高 |
高侵入性、操作复杂、有凝血缺陷的动物具有术后并发症风险 |
50-100uL |
|
|
脾包膜内注射 |
100uL |
|||
|
肝实质注射 |
3-5个位点,总量100-200uL |
腹腔注射和尾静脉注射操作简单,且不需要开腹腔,是较为常见的递送方法,12次方滴度以上的病毒,小鼠腹腔注射需要200-300μl,尾静脉注射体积大约100-200μl。
1. 尾静脉注射:
1)把小鼠放入尾静脉注射的装置中。
2)用70%的酒精消毒小鼠尾部。注意保持小鼠尾部温暖,太冷血管则会收缩。
3)用左手食指拇指拉住小鼠尾巴,稍用力拉直,然后食指稍微向前向上,使尾巴稍微弯折。可以在弯折处进针注射病毒(27-30G胰岛素针,100uL/小鼠)。
4)缓缓注射,完成后保持5-10秒防止病毒回流。
5)拔针,用手指或者干的无菌棉球或纱布按压几秒。
2. 腹腔注射:
1.抓取小鼠,使其腹部朝上头部略向下垂。
2.抓紧背部皮肤使腹部皮肤紧绷,于腹腔下边缘位置(左/右侧)进针。
3.针头沿皮下向前推进2-3cm,针头与皮肤呈45°角刺入腹膜。
4.回抽无回流物,缓慢推入药物。
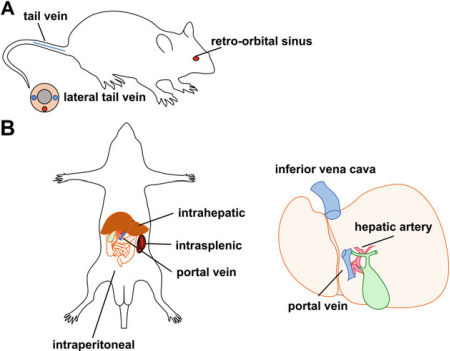
图2. 小鼠肝靶向AAV常见递送方式。A.小鼠侧视图,展示尾侧静脉或眶后窦的静脉注射路径。B.小鼠仰卧视图,展示非手术腹膜内注射和手术肝内、脾内和门静脉注射路径。[3]
3. 肝门静脉注射:需要先用手术刀划开小鼠的第二肋骨和第四乳头之间的区域,长度约3cm,用消毒棉签小心把大小肠等内脏拉出来,找到肝门静脉,用32G针头注射器吸入50-100μL病毒液,在肝脏下方距离约1cm的位置,以小于5°的夹角沿着肝门静脉缓缓插入注射病毒液。(图2、图3)
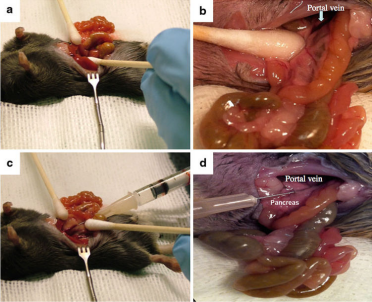
图3. 将病毒载体通过肝门静脉注射至小鼠体内。(a) 肠道和胰腺移位以进入门静脉。(b) 门静脉暴露。门静脉正尾部的区域必须足够平坦,以允许针头进入血管而不会阻碍注射器。棉签用于“缩回”胰腺,以给血管施加张力。(c) 通过多层膜组织插入针头进入门静脉。操作人员应该能到看到血管中针头的斜面。(d) 载体管理。在观察肝脏的同时按下柱塞时,肝脏应明显变白。 [4]
4. 肝实质注射:注射前需要手术暴露小鼠的肝左外叶,使用29G针头胰岛素注射器将病毒注射到肝实质中,选择3-5个不同的位点注射,总量100-200μL。
5. 脾包膜内注射:首先用手术刀在小鼠的腹部左侧划开一个长度约1cm的切口,暴露脾脏,用30G针头注射器吸入100μL病毒液,于脾包膜下注射。
四.参考文献
[1] Lorente S,et al. The liver, a functionalized vascular structure. Sci Rep. 2020 Oct 1;10(1):16194. doi: 10.1038/s41598-020-73208-8.
[2] Barrie J. Anthony; Grant A. Ramm; Donald P. McManus (2012). Role of resident liver cells in the pathogenesis of schistosomiasis. , 28(12), doi:10.1016/j.pt.2012.09.005
[3] Adeno-Associated Virus Vectors 2019, Volume 1950, ISBN: 978-1-4939-9138-9, doi: 10.1007/978-1-4939-9139-6
[4] Sherman A, et al. Portal vein delivery of viral vectors for gene therapy for hemophilia. Methods Mol Biol. 2014;1114:413-26. doi: 10.1007/978-1-62703-761-7_27.


